7月6日,上海科技大学生命学院林照博团队与黄行许团队合作,在Molecular Therapy上报道了新版本先导编辑器(prime editor, PE)的开发,并对其在胚胎干细胞中的应用做了测试及评估。8月10日,两团队再次合作于Molecular Therapy-Nucleic Acids上在线发表研究论文,探索了腺嘌呤碱基编辑器 (ABE) 在多能干细胞的应用及安全性。
多能干细胞能够无限期自我更新并分化成三个胚层细胞类型,这对再生医学、细胞治疗、类器官研究等至关重要。在过去的十年中,基于CRISPR/Cas9的基因编辑技术及其脱靶在许多细胞株中已得到验证。但先前多能干细胞中的研究发现, Cas9对DNA的切割会造成DNA大片段的缺失以及p53突变细胞的富集。因此,开发新的基因编辑工具,对下一代干细胞的应用以及评估其安全性至关重要。
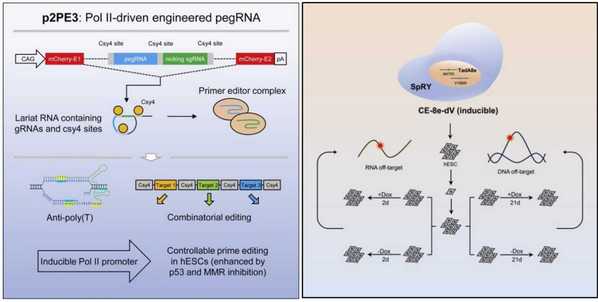
先导编辑工具可以在基因组中精确引入点突变、小插入或小缺失,在多种遗传疾病的治疗中有着巨大的应用前景。然而,典型的先导编辑PE3系统效率较低,尤其是在原代细胞或多能干细胞中。为了解决以上困境,联合团队在此前开发的ePE3工具的基础上进行了一系列优化,新系统p2PE3与ePE3编辑效率类似。
进一步研究发现,将p2PE3应用于人胚胎干细胞后,同时抑制DNA错配修复和DNA损伤反应可进一步提高先导编辑器在人胚胎干细胞上的效率。由于RNA聚合酶III类启动子无法进行可诱导或组织特异性表达,p2PE3则可以通过使用可诱导或组织特异性表达的启动子来实现。研究人员利用TRE3GS启动子通过诱导pegRNA的表达,在人胚胎干细胞上实现了可控的先导编辑。
8月发表的论文则对腺嘌呤碱基编辑器 (ABE) 在多能干细胞的应用及安全性做了探索。ABE作为基因编辑工具之一,可以在基因组中实现A-to-G的碱基替换。由于ABE可极大地避免p53的激活,因此它更适合去矫正人类干细胞相关疾病突变。多能干细胞上与ABE脱靶效应相关的研究目前极度匮乏,在多能干细胞上的安全性还有待商榷。
联合团队在多能干细胞中验证了三种降低ABE脱靶效应的策略,并将这几种方法组合,发现结合三种方法的编辑器CE-8e-dV的编辑效率并没有被影响,而RNA的脱靶效应则进一步降低。对CE-8e-dV在多能干细胞中的安全性检测,未发现明显的sgRNA非依赖性的RNA及DNA脱靶效应。研究结果说明该编辑器在多能干细胞中具有较好的安全性。
在上述工作中,联合团队开发并评估了新的先导编辑器p2PE3及碱基编辑器CE-8e-dV在多能干细胞中的效率及安全性,为下一代干细胞应用添加了新的可用工具。两篇论文主要由上海科技大学助理研究员张振武博士与2019级博士生黄诗圣、2021级博士生陶皖豫作为共同第一作者完成,林照博和黄行许为通讯作者。
论文1:Broadening prime editing toolkits using RNA-Pol-II-driven engineered pegRNA
链接:https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(22)00423-3
论文2:Engineering an adenine base editor in human embryonic stem cells with minimal DNA and RNA off-target activities
链接:https://www.cell.com/molecular-therapy-family/nucleic-acids/fulltext/S2162-2531(22)00195-0





